מהי תצורה אלקטרונית של אשלגן
כיצד נראית תצורה אלקטרונית של אשלגן? כדי לענות על שאלה זו, הבה נבחן את מבנה האטום, כמו גם את הכללים לחלוקת האלקטרונים על פני רמות ו sublevels.
מכניקה קוונטית
תצורה אלקטרונית של אשלגן מתוארמשוואת שרדינגר. הוא מחבר את האנרגיה הפוטנציאלית של האינטראקציה של הגרעין והאלקטרונים, כמו גם את הדחייה בין חלקיקים בעלי מטען שווה. מכניקת הקוונטים משתמשת בפוסטולטים של משוואה זו, ומסבירה את קיומה של עתודת אנרגיה מסוימת עבור כל רמת אנרגיה.

אטומי אלקטרונים רבים
תצורה אלקטרונית של אשלגן נרשם עםעקרון האיסור של פאולי. אם ניקח בחשבון את המוזרויות של הטבע גל של אלקטרונים, הוא הניח כי כל חלקיק שלילי ממוקם על "מסלולית", כלומר, יש קיום מרחבי מסוים. באשר אטום אלקטרון רבים, שאליו אשלגן שייך, לא יותר משני אלקטרונים יכול להיות ממוקם על כל מסלול. כתוצאה מכך זוהו ארבעה מספרים קוונטיים, המאפיינים את מצב האלקטרון במרווח הזמן המדובר.

שלטון קלצ'קובסקי
תצורה אלקטרונית של אשלגן מורכבאת הבסיס של כלל נגזר על ידי Klechkovsky. בואו נחשוב על זה ביתר פירוט. תלוי אילו אלקטרונים מסלולית ממוקמים, יש להם כמות מסוימת של אנרגיה. ראשית, יש חלוקה של חלקיקים שיש להם עתודת אנרגיה קטנה יותר.
כמו מאפיין האנרגיה העיקרי עבור האלקטרון הוא המספר הקוונטי העיקרי המתאים למספר התקופה.
באטום רב אלקטרונים, לא רקמשיכה לגרעין האלקטרונים, אלא גם דחייה ביניהם. עם עלייה של ספין הכולל של החלקיקים, האנרגיה של פגז אלקטרונים פוחתת, ואת מספר האלקטרונים בעלי כיוון זהה של eigenmoments של תנועה מגביר. תלות דומה בכימיה קוונטית נקראת כלל Hund.
בהתבסס על שני כללים אלה,תצורה אלקטרונית של אטום אשלגן. ספקטרום אטומי מאפשרים לקבוע את מצב הקרקע של אלקטרונים, כלומר, לזהות את החלקיקים שיש להם עתודת אנרגיה מינימלית.
המהות של בניית נוסחה אלקטרונית לאטום אשלגן רב-אלקטרוני היא פשוטה למדי: למערכת האלקטרונית חייבת להיות אנרגיה מינימלית, בהתאם לעקרון הרחקת פאולי.
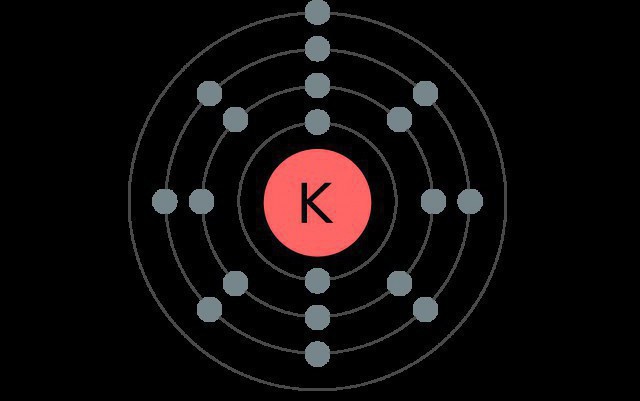
דוגמאות להתפלגות האלקטרונים על פני רמות האנרגיה
לפני שקול מה אלקטרוניתאת התצורה של יון אשלגן, אנו נותנים דוגמאות פשוטות. באטום המימן, הגרעין מכיל פרוטון חיובי אחד. סביב הגרעין, אחד האלקטרון מסתובב במסלול. במצב הקרקע את הנוסחה האלקטרונית של מימן יש את הטופס הבא: 1s. הבה נבחן את התכונות של כיוון הספין של אלקטרון זה. על פי שלטון הונד, הוא מופנה יחד עם החלק האחורי של הגרעין.
עבור הליום, אשר יש מספר הזמנה השני בטבלה אלמנט, שני אלקטרונים ממוקמים על מסלול אחד. כל אחד מהם יש ספין ½, יש כיוון שונה של סיבוב.
אלמנטים של רמת האנרגיה השנייה יש שני פגזים, כל אחד יש אספקת משלו של אנרגיה.
אשלגן הוא מרכיב של התקופה הרביעית של מערכת האלמנטים, ולכן יש ארבע רמות אלקטרוניות, שכל אחד מהם מכיל סוגים שונים של sublevels.
במצב הרגיל, אטום של מתכת זו יש את התצורה הבאה: 1s22s22p63s23p64s1.
תצורה אלקטרונית של יון אשלגן יש הבדליםמן האטום. על מפלס האנרגיה החיצוני של המתכת יש אלקטרון אחד valence. מאז מופחתת אשלגן מופחתת תכונות, במהלך אינטראקציות עם אטומים אחרים זה נותן אלקטרון valence, הופך יון חיובי (קטיון), אשר יש את תצורה אלקטרונית הבאה: 1s22s22p63s23p64s0.

מסקנה
עבור כל רכיב כימי,הממוקם בטבלה המחזורית, אתה יכול לעשות תצורות אלקטרוניות, חמושים עם הכלל Hund, עקרון האיסור פאולי, ואת הנוסחה Klechkovsky. בנוסף תצורות אלקטרוניות של אטומים בכימיה אנאורגנית, נוסחאות קטיונים ואניונים שנוצרו כתוצאה אינטראקציות כימיות גם טופס.
</ p>







