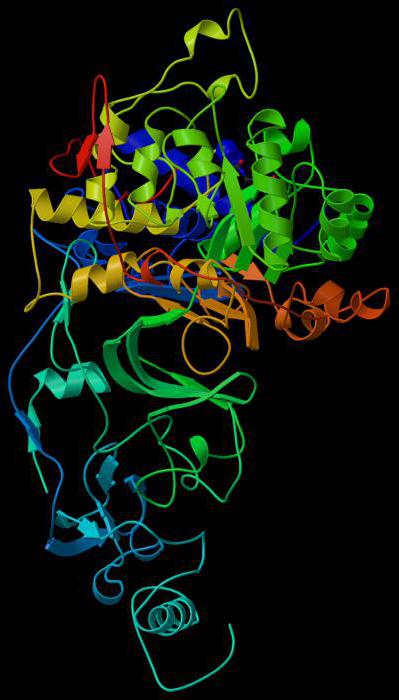
אנזים Catalase: תכונות בסיסיות
Catalase - אנזים שנמצא כמעט בכלאורגניזמים חיים. הפונקציה העיקרית שלו היא לזרז את התגובה הפירוק של מי חמצן לחומרים מזיקים לגוף. קטלאז הוא בעל חשיבות רבה לפעילות חיונית של תאים, שכן הוא מגן עליהם מפני הרס על ידי צורות פעילות של חמצן.

מידע כללי
אנזים קטלז מתייחס oxidoreductases - סוג עצום של אנזימים כי לקטרז את העברת האלקטרונים מן המולקולה הפחתת (התורם) כדי מולקולה חמצון (acceptor).
PH אופטימלי עבור קטליז האדםהגוף הוא בערך 7, עם זאת, שיעור התגובה אינו משתנה באופן משמעותי בערכים של מדד המימן מ 6.8 ל 7.5. ה- pH האופטימלי עבור קטליזים אחרים נע בין 4 ל -11, בהתאם לסוג האורגניזם. הטמפרטורה האופטימלית משתנה גם, עבור אדם זה בערך 37o C
Catalase הוא אחד האנזימים המהירים ביותר. רק מולקולה אחת יכולה להמיר מיליוני פרודות חמצן מימן לתוך מים וחמצן בשנייה. מנקודת המבט של האנזיולוגיה, זה אומר כי האנזים קטלאז מאופיין במספר רב של מהפכות.

מבנה האנזים
קטלאז הוא טטרמר של ארבעהשרשראות פוליפפטיד, שכל אחד מהם יש אורך של יותר מ 500 חומצות אמינו. האנזים יש ארבע קבוצות של heme פורפיר, בשל אשר מגיב עם צורות פעילות של חמצן. חמצון heme היא קבוצה תותבת של catalase.
היסטוריה של גילוי
קטלאז לא היה ידוע למדענים עד 1818,ואילו לואי ז'אק טנאר, כימאי שגילה מי חמצן בתאים חיים, לא הניח שהרסו נגרם כתוצאה מפעולה של חומר ביולוגי לא ידוע קודם לכן.

בשנת 1900 הופיע לראשונה הכימאי הגרמני אוסקר לבלטווח של "קטליז" עבור ייעוד של חומר מסתורי כי decomposes חמצן. הוא גם הצליח לענות על השאלה, שם את האנזים catalase הוא הכיל. כתוצאה מניסויים רבים, גילה אוסקר לב כי אנזים זה אופייני כמעט לכל בעלי החיים ולאורגניזמים הצמחיים. בתא חי, כמו אנזימים רבים אחרים, catalase נכלל peroxisomes.
ב- 1937, לראשונה, היה אפשר להתגבשקטלז מבשר בקר. בשנת 1938, המסה המולקולרית של האנזים היה נחוש להיות 250 kDa. בשנת 1981, מדענים קיבלו תמונה של מבנה תלת מימדי של קטליז בקר.
קטליזה של מי חמצן
למרות העובדה כי מי חמצן הוא תוצר של תהליכים מטבוליים רבים נורמלי, זה לא מזיק לגוף.
התגובה של הפירוק של מי חמצן ברקמות חיות:
2 ח2הו2 → 2 H2O + O2
מנגנון מולקולרי של פרוקסיד מחשוףמימן catalase אנזים עדיין לא נחקרו. ההנחה היא כי התגובה מתרחשת בשני שלבים - בשלב הראשון, ברזל בקבוצה תותבת של קטליז נקשר אטום חמצן של פרוקסיד, בעוד מולקולה אחת של מים משוחרר. בשלב השני, ההמה המחומצן מגיב עם מולקולה אחרת של מי חמצן, וכתוצאה מכך היווצרות מולקולה נוספת של מים ומולקולה אחת של חמצן.
בשל פעולה זו של catalase אנזים עלמי חמצן, נוכחות של חומר פעיל זה בדגימות רקמה קל לקבוע. לשם כך, פשוט להוסיף כמות קטנה של מי חמצן למדגם ולצפות התגובה. נוכחות של אנזים מסומן על ידי היווצרות של בועות חמצן. תגובה זו טובה כי זה לא דורש שום ציוד מיוחד או כלים - זה ניתן לצפות בעין בלתי מזוינת.

ראוי לציין כי יון של כל מתכת כבדהיכול לשמש מעכב לא תחרותי של קטליז. בנוסף, כל ציאניד ידוע מתנהג כמו מעכב catalase תחרותי, אם יש הרבה מי חמצן ברקמות. Arsenates לשחק את התפקיד של activators.
יישום
ההשפעה המבישה של האנזים קטלז על מי חמצן מצא יישום בתעשיית המזון - אנזים זה מסיר מן החלב ח2אודות2 לפני בישול הגבינה. יישום נוסף הוא אריזות מזון מיוחדות, אשר מגן על מוצרים מפני חמצון. Catalase משמש גם בתעשיית הטקסטיל כדי להסיר מי חמצן מ רקמות.
הוא משמש בכמויות קטנותהיגיינה של עדשות מגע. כמה חיטוי יש מי חמצן בהרכב, ו catalase משמש לשבור את הרכיב הזה לפני שימוש חוזר בעדשות.
פעילות
הפעילות של אנזים catalase תלוי בגילאורגניזם. ברקמות צעירות, הפעילות של האנזים גבוהה בהרבה מזו הישנה. עם הגיל, הן בבני אדם והן בבעלי חיים, הפעילות של קטליז בהדרגה פוחתת כתוצאה מזדקנות של איברים ורקמות.
על פי מחקר שנערך לאחרונה, ירידהפעילות של קטליז הוא אחד הגורמים האפשריים של האפור של השיער. מי חמצן נוצר כל הזמן בגוף האדם, אבל לא מזיק - קטלאז במהירות decomposes זה. אבל אם את רמת האנזים הזה מופחת, ברור כי לא כל מי חמצן הוא מזרז על ידי האנזים. לכן, זה discolours את השיער מבפנים, המסת צבעים טבעיים. גילוי בלתי צפוי זה נבדק כעת על ידי חוקרים, ואולי, יהיה, לשחק תפקיד בפיתוח תרופות להשעות שיער מאפיר.
</ p>